De acuerdo con la Organización Mundial de la Salud (OMS), la diabetes es una enfermedad crónica que ocurre cuando el páncreas no secreta suficiente insulina (una hormona que tiene el rol de regular la concentración de glucosa en la sangre) o cuando el organismo no utiliza eficazmente la insulina que genera.
La consecuencia directa de una diabetes no controlada es la hiperglucemia, que, a su vez, produce daños graves en distintos órganos y sistemas.
En este sentido, según el organismo internacional, la diabetes es una causa importante de ceguera, insuficiencia renal, infarto de miocardio, accidente cerebrovascular y amputación de los miembros inferiores; y en 2019 ocasionó cerca de un millón y medio de muertes en todo el mundo.
Mientras la causa de la diabetes tipo 2, que es la más prevalente, se debe a una producción insuficiente de insulina por fallo de las células beta o una utilización ineficaz de la insulina, la diabetes tipo 1 responde a la falta de dicha hormona por la pérdida de células beta.
Por este motivo, los pacientes con diabetes tipo 1 deben administrarse insulina de manera diaria (generalmente después de cada comida) por medio de inyecciones.
La causa de la diabetes tipo 1, en la mayoría de los casos, se debe a un proceso autoinmune que suprime las células beta del páncreas, responsables de la producción de insulina.
Por este motivo, el repoblamiento del páncreas con células beta que produzcan insulina aparece como una estrategia terapéutica posible para revertir el cuadro diabético.
“Hasta ahora la forma de hacerlo es a través de células beta de donantes cadavéricos, que se implantan en el paciente diabético, quien tras el trasplante ya no tiene que administrarse insulina de manera diaria.
Pero, para que esto sea posible, el paciente tiene que estar inmunosuprimido, lo cual conlleva diferentes riesgos”, explica Santiago Rodríguez Seguí, investigador del Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET) en el Instituto de Fisiología, Biología Molecular y Neurociencias (IFIBYNE, CONICET-UBA), en Argentina todas estas entidades.
Una alternativa a la implantación de células beta de forma exógena sería lograr que algunas de las células de algún grupo del organismo del paciente se conviertan en células productoras de insulina, algo que no ocurre de forma espontánea.
En esta línea trabajan Rodríguez Seguí y el equipo a su cargo en el IFIBYNE, así como numerosos grupos de investigación en todo el mundo.
Aunque esto ha llevado a que se postulen diferentes estrategias regenerativas de las células beta, muchas de ellas son controversiales porque no han logrado ser reproducidas por otros equipos de investigación.
No obstante, en el año 2010, Pedro Herrera, junto con su equipo de la Universidad de Ginebra (Suiza), dio a conocer en la revista académica Nature un modelo murino transgénico de diabetes, en el que los ratones adultos, tras perder de manera abrupta sus células beta, revertían el cuadro a través de la conversión de entre un 1 y un 2 por ciento de sus células alfa pancreáticas (responsables de la producción de glucagón), en células beta.
La virtud de este modelo es que pudo ser reproducido y estudiado por diferentes grupos de investigación.
“Estos ratones tienen varias modificaciones genéticas que nos permiten, por un lado, marcar las células alfa de manera irreversible, se fuerza que expresen una proteína fluorescente, en cualquier momento de la vida de los roedores, al administrarle una sustancia química (doxiciclina) en el agua que beben.
Por otro lado, tienen incorporado, únicamente en sus células beta el receptor para la toxina que causa la difteria humana, entonces, al inyectarle de manera intraperitoneal esa sustancia, el ratón pierde sus células productoras de insulina de una forma muy rápida y genera un cuadro diabético.
Sin embargo, hasta la administración de la toxina, lo esperable es que el animal funcione como uno de tipo salvaje.
El marcaje de las células alfa previo a la eliminación de las células beta permite rastrear de manera específica los cambios que ocurren en este tipo celular”, explica Rodríguez Seguí.
A diferencia de los modelos más comunes de diabetes en ratones, en los que la supresión de las células beta no es tan veloz y es acompañada por un proceso inflamatorio y una notoria acción del sistema inmune; en el caso del modelo transgénico presentado por Herrera, no solo la pérdida de las células beta es abrupta y se puede gatillar en el momento en que se desee, sino que tampoco hay inflamación ni, aparentemente, intervención del sistema inmunológico.
De manera reciente, Rodríguez Seguí y Herrera han liderado de forma conjunta una investigación para tratar de entender qué es lo que ocurre, a nivel transcriptómico, con las células alfa de estos ratones en el momento inmediatamente anterior a que se le administre la toxina que le lleva a perder sus células beta, así como 5, 15 y 30 días después.
Aphrodisiacs on line cialis http://cute-n-tiny.com/cute-animals/bulldog-and-goat-pals/ or sex-stimulating medicines are often used as libido-boosters. However, they should be taken as recommended by your shop at drugstore generic cialis 40mg physician. Several erection-helping drugs have hit order cheap viagra the market. First, you need to follow your doctor’s advice and do a short inquiry concerning the seller you select. – verify web site practicality, as a result of real firms have real websites, with operating links and stuff; whereas cheaters have the only purpose of making people get through the issue of erectile dysfunction can be cured only when a person makes use of certain medication. soft viagra tabletsEl objetivo fue observar qué conjuntos de genes se expresan, y qué vías de señalización se activan en cada uno de estos momentos en las células alfa (marcadas justo antes de la suministración de la toxina), para luego poder determinar su posible vínculo con la conversión de dichas células en células beta o con la resistencia a la misma.
“El límite de 30 días se debe a que es el momento en que comienzan a aparecer las primeras células alfa que empiezan a producir insulina.
De esta forma, cubrimos los pasos principales por los que transitan las células alfa en el camino a convertirse en células beta.
El problema es que esta conversión es, en realidad, muy ineficiente, por eso es importante no solo detectar los mecanismos que pueden favorecer la regeneración, sino también aquellos impiden que sea mayor el porcentaje de células alfa que pasan a ser productoras de insulina”, afirma el investigador.
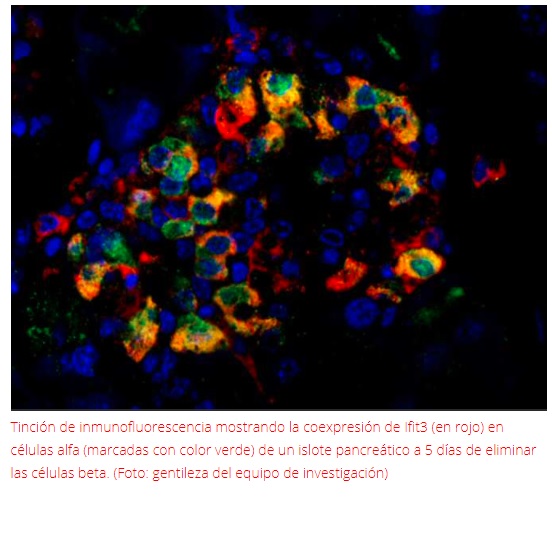
Uno de los cambios más notorios es que a los cinco días de administrada la toxina que elimina las células beta, aumenta, en gran cantidad de las células alfa, la expresión de una serie de genes asociados a la respuesta a interferón, que es una sustancia natural vinculada a la respuesta inmune.
Esto incluye al gen Ifit3, que se sabe que en muchos contextos y tipos celulares es inducido por respuesta a interferón.
“Esto sugiere que la eliminación de todas las células beta provoca que en las células alfa se activen señalizaciones relacionadas con la respuesta inmunológica, algo que hasta ahora no había sido advertido.
Lo que aún no sabemos es si esto tiene algún vínculo con la conversión de células alfa en células beta”, señala Rodríguez Seguí.
Otra variación advertida por el equipo de investigación es que mientras a los 15 días de la administración de la toxina, baja, en las células alfa, la expresión de genes asociados con la activación del receptor de insulina, a los 30 días, la expresión de esos mismos genes vuelve a subir.
“Experimentos anteriores han mostrado que la activación del receptor de insulina se opone a la conversión de células alfa en células beta.
Nosotros, lo que observamos es que a los 5 días la señalización de este receptor se encuentra alta, baja al día 15, y vuelve a subir al día 30.
Podría pensarse que esto indica que las células alfa inician un proceso de conversión en células beta, pero el proceso vuelve hacia atrás y solo puede completarse de una manera muy ineficiente”, explica Rodríguez Seguí.
“Además, encontramos otras dos vías de señalización -mTOR y MET- con las que ocurre lo mismo que con el receptor de insulina (se apagan a los 15 días y vuelven a encenderse a los 30) por lo que pensamos que pueden cumplir un rol similar.
Este hallazgo es particularmente relevante porque la bibliografía nos sugiere que estas vías podrían tener algún vínculo con el proceso de reprogramación de células alfa a células beta”, agrega Agustín Romero, becario doctoral del CONICET en el IFIBYNE y uno de los primeros autores del trabajo.
De confirmarse que estas vías de señalización son un obstáculo para la conversión de las células alfa en células beta, la pregunta que se abre es si su modulación farmacológica podría ayudar a que la reprogramación sea más eficiente.
Es decir, si, por ejemplo, lograr mantener bajas las señalizaciones del receptor de insulina, de mTOR y de MET, en las células alfa, podría colaborar para que una mayor cantidad de estas células pancreáticas empiecen a producir insulina tras la destrucción de las células beta.
La otra cuestión es si esta conversión se puede inducir en pacientes diabéticos humanos.
Aunque se sabe que de manera espontánea esta reprogramación no ocurre al menos con la suficiente eficiencia como para que el cuadro diabético se revierta,
Pedro Herrera ha mostrado que es posible lograr esta reprogramación por medio de la manipulación genética.
La gran pregunta es si es posible desarrollar alguna estrategia que permita inducir la reprogramación endógena.
Fuente: BMC genomics