Los macrófagos que llevan “mochilas” de micropartículas reducen el tamaño de la lesión y la inflamación en el sitio de las lesiones cerebrales, mitigando el daño.
Centíficos han creado un nuevo tratamiento para la lesión cerebral traumática (TBI) que redujo las lesiones cerebrales en un 56% y redujo significativamente los niveles de inflamación local en cerdos.
El nuevo enfoque aprovecha los macrófagos, un tipo de glóbulo blanco que puede aumentar o disminuir la inflamación en el cuerpo en respuesta a infecciones y lesiones.
El equipo creó micropartículas en forma de disco llamadas “mochilas” que contienen moléculas antiinflamatorias y luego las unieron directamente a los macrófagos.
Estas moléculas mantuvieron las células en un estado antiinflamatorio cuando llegaron al sitio de la lesión en el cerebro, lo que les permitió reducir la inflamación local y mitigar el daño causado.
“Cada año, millones de personas sufren una lesión cerebral traumática, pero actualmente no existe ningún tratamiento más allá de controlar los síntomas.
Hemos aplicado nuestra tecnología de mochila celular, que utilizamos anteriormente para mejorar la respuesta inflamatoria de los macrófagos a los tumores cancerosos, para administrar un tratamiento antiinflamatorio localizado en el cerebro, que ayuda a mitigar la cascada de inflamación descontrolada que causa daño tisular y la muerte en un ser humano”, dijo el autor principal Samir Mitragotri, Ph.D., en cuyo laboratorio se realizó la investigación.
Más de un millón de personas en los EE. UU. sufren una lesión cerebral traumática (TBI) cada año, alrededor de 230.000 de ellas son hospitalizadas y casi 70.000 mueren por causas relacionadas con TBI.
Actualmente no existe ningún tratamiento para el daño causado al tejido cerebral durante una lesión cerebral traumática, más allá de controlar los síntomas del paciente.
Uno de los principales impulsores del daño causado por una TBI es una cascada inflamatoria desbocada en el cerebro.
A medida que las células mueren por el impacto, liberan un cóctel de moléculas de citocinas proinflamatorias que atraen a las células inmunitarias para limpiar el daño.
Pero las mismas moléculas de citoquinas también pueden alterar la barrera hematoencefálica, lo que hace que la sangre se filtre hacia el cerebro.
La acumulación de sangre en el cerebro provoca hinchazón, alteración del suministro de oxígeno y aumento de la inflamación, y crea un círculo vicioso de hemorragia y daño que provoca aún más muerte celular.
El laboratorio Mitragotri vio una oportunidad en este problema.
“En general, se cree que las terapias antiinflamatorias pueden ser efectivas para tratar la lesión cerebral traumática, pero hasta ahora ninguna de ellas ha demostrado ser efectiva clínicamente.
Nuestro trabajo anterior con macrófagos nos ha demostrado que podemos utilizar nuestra tecnología de mochila para dirigir eficazmente su comportamiento cuando llegan al lugar de la lesión.
Dado que estas células ya son actores activos en la respuesta inmune natural del cuerpo a una lesión cerebral traumática, teníamos la corazonada de que podíamos aumentar esa biología preexistente para reducir el daño inicial”, dijo el coautor Rick Liao, Ph.D., becario postdoctoral. en el Instituto Wyss y SEAS.
Los macrófagos son células muy maleables y pueden “alternar” entre estados proinflamatorios y antiinflamatorios.
Si bien el trabajo anterior del equipo en cáncer se había centrado en mantener los macrófagos en un estado proinflamatorio cuando llegan al microambiente de un tumor que reduce la inflamación, este nuevo proyecto intentaría hacer lo contrario: mantener a los macrófagos “calmados” en el entorno plagado de inflamación de una lesión cerebral.
Para hacerlo, utilizaron una “mochila” en forma de disco que habían diseñado previamente para tratar la esclerosis múltiple y que contenía capas de dos moléculas antiinflamatorias: dexametasona, un esteroide, e interleucina-4, una citoquina que estimula a los macrófagos a adoptar una reacción antiinflamatoria.
Luego incubaron estas micropartículas con macrófagos humanos y porcinos in vitro y vieron que las mochilas se adherían de forma estable a las células sin causar ningún efecto negativo.
También observaron que la aplicación de sus mochilas disminuía la expresión de biomarcadores proinflamatorios y aumentaba la expresión de biomarcadores antiinflamatorios, manteniendo a los macrófagos de los cerdos en estado de curación.
Pero para demostrar que este cambio funcionaría en el cuerpo, tuvieron que probar in vivo los macrófagos que portaban mochilas.
Eligieron a los cerdos como su organismo modelo porque las estructuras de sus cerebros y sus respuestas a las lesiones se parecen más a las de los humanos que a las de los ratones.
“Probablemente nuestro mayor desafío en este proyecto fue aumentar la producción para que coincidiera con lo que necesitábamos para ejecutar los experimentos.
Nuestros estudios anteriores se realizaron en roedores, lo que requirió alrededor de dos millones de macrófagos y cuatro millones de mochilas administradas por sujeto.
Para el estudio porcino, necesitábamos 100 millones de macrófagos y 200 millones de mochilas por sujeto (en la escala de lo que se administraría en humanos) y muchas manos amigas”, dijo la coautora Neha Kapate, Ph.D., postdoctoral. Fellow del Wyss Institute y SEAS.
El equipo final estuvo formado por más de 20 miembros de todo el Instituto Wyss, Harvard, MIT y Mass General Hospital (MGH).
Una vez que generaron suficientes macrófagos porcinos que llevaban mochilas, los infundieron en el torrente sanguíneo de los cerdos cuatro horas después de una lesión cerebral traumática.
Siete días después, analizaron los cerebros de los animales.
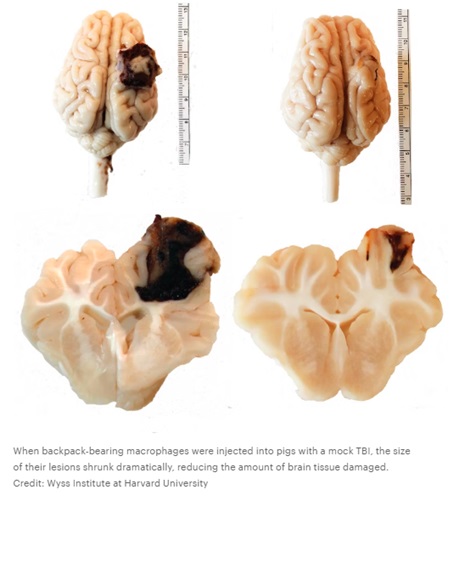
Los cerdos que habían recibido el tratamiento con macrófagos mostraron una alta concentración de células en el área que rodea inmediatamente el sitio de la lesión, sus lesiones eran un 56% más pequeñas y hubo significativamente menos hemorragia que en los animales no tratados.
Las células inmunes locales también mostraron una menor cantidad de un marcador de activación proinflamatoria llamado CD80, lo que indica que los macrófagos habían logrado controlar el daño al reducir la inflamación en el cerebro.
Corroborando esos datos, los niveles de dos biomarcadores solubles de inflamación en la sangre y el líquido cefalorraquídeo fueron más bajos en los animales tratados que en los no tratados.
El tratamiento con macrófagos tampoco provocó ningún efecto negativo.
El equipo planea realizar estudios futuros que se centren en dilucidar exactamente cómo su terapia antiinflamatoria con macrófagos afecta la integridad de la barrera hematoencefálica para prevenir hemorragias, lo que también podría ser prometedor para el tratamiento de otras afecciones como los accidentes cerebrovasculares hemorrágicos.
“Históricamente, la susceptibilidad de los macrófagos a su entorno local ha impedido que los científicos aprovechen al máximo sus capacidades de modulación inmune.
Este impresionante estudio describe una terapia basada en macrófagos verdaderamente novedosa y potencialmente poderosa para tratar la inflamación que es la causa fundamental de tantas enfermedades humanas de una manera efectiva y no invasiva que trabaja con la biología en lugar de contra ella”, afirmó el director fundador de Wyss Donald Ingber, M.D., Ph.D. Ingber.
Fuente: Wyss Institute