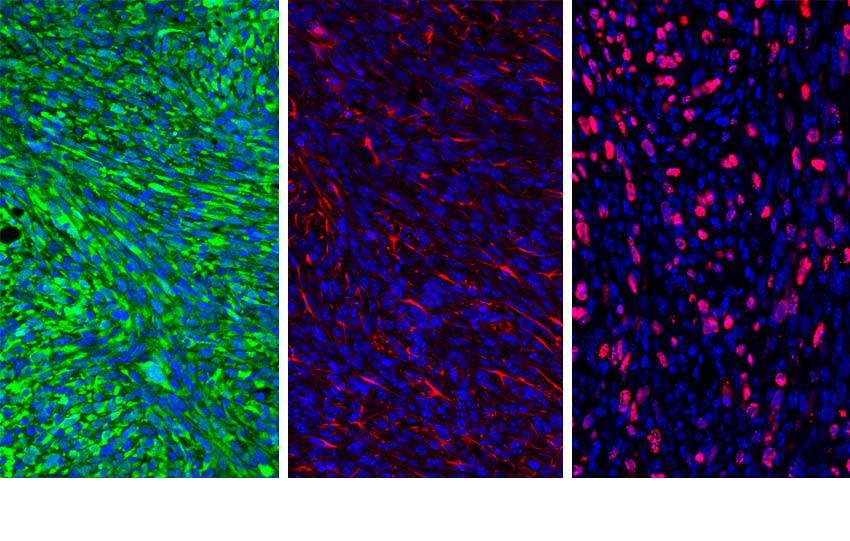
La nueva estrategia, estudiada en ratones, supera la barrera hematoencefálica y rompe el escudo que los tumores construyen contra las defensas.
Científicos del Centro de Cáncer Rogel de la Universidad de Michigan se mostraron optimistas cuando identificaron una pequeña molécula que bloqueaba una vía clave en los tumores cerebrales.
Pero había un problema: cómo hacer pasar el inhibidor a través del torrente sanguíneo y llegar al cerebro para llegar al tumor.
En colaboración con varios laboratorios, los equipos fabricaron una nanopartícula para contener el inhibidor y los resultados fueron incluso mejores de lo esperado.
Las nanopartículas no solo administraron el inhibidor al tumor en modelos de ratón, donde el fármaco activó con éxito el sistema inmunitario para eliminar el cáncer, sino que el proceso activó la memoria inmunitaria para que también se eliminara un tumor reintroducido, una señal de que este posible nuevo enfoque no solo podría tratar los tumores cerebrales, sino también prevenir o retrasar las recurrencias.
“Nadie podría introducir esta molécula en el cerebro. Es realmente un gran hito.
Los resultados de los pacientes con glioma no han mejorado en los últimos 30 años”, dijo Maria G. Castro, Ph.D., R.C. Profesora colegiado Schneider de Neurocirugía en Michigan Medicine. Castro es la autora principal del estudio.
“A pesar de las ganancias de supervivencia en muchos tipos de cáncer, el glioma sigue siendo un reto obstinado, ya que solo el 5 % de los pacientes viven cinco años después de su diagnóstico“, dijo el autor del estudio, Pedro R. Lowenstein, M.D., Ph.D., Richard C. Schneider Collegiate Professor of Neurocirugía en Michigan Medicine.
Los gliomas a menudo son resistentes a las terapias tradicionales, y el entorno dentro del tumor suprime el sistema inmunitario, lo que hace que las nuevas terapias inmunitarias sean ineficaces.
Agregue a eso el desafío de atravesar la barrera hematoencefálica, y se vuelve aún más difícil administrar tratamientos efectivos para estos tumores.
El laboratorio de Castro-Lowenstein vio una oportunidad.
El inhibidor de molécula pequeña AMD3100 se desarrolló para bloquear la acción de CXCR12, una citoquina liberada por las células de glioma que construye un escudo alrededor del sistema inmunitario, evitando que se dispare contra el tumor invasor.
Los investigadores demostraron en modelos de ratones con glioma que AMD3100 impedía que CXCR12 se uniera a las células mieloides inmunosupresoras.
Al desarmar estas células, el sistema inmunológico permanece intacto y puede atacar las células tumorales.
Pero AMD3100 estaba teniendo problemas para llegar al tumor.
La droga no viajó bien a través del torrente sanguíneo y no atravesó la barrera hematoencefálica, un problema clave para que las drogas lleguen al cerebro.
El laboratorio de Castro-Lowenstein colaboró con Joerg Lahann, Ph.D., Profesor Colegiado de Ingeniería Química Wolfgang Pauli en la Facultad de Ingeniería de la U-M, para crear nanopartículas basadas en proteínas para encapsular el inhibidor, con la esperanza de ayudarlo a pasar por el torrente sanguíneo.
Castro también se conectó con Anuska V. Andjelkovic, M.D., Ph.D., profesora de patología y profesora investigadora de neurocirugía en Michigan Medicine, cuya investigación se centra en la barrera hematoencefálica.
Señalan que los tumores de glioma crean vasos sanguíneos anormales, lo que interfiere con el flujo sanguíneo normal.
Los investigadores inyectaron nanopartículas cargadas con AMD3100 en ratones con gliomas.
Las nanopartículas contenían un péptido en la superficie que se une a una proteína que se encuentra principalmente en las células tumorales cerebrales.
A medida que las nanopartículas viajaban por el torrente sanguíneo hacia el tumor, liberaban AMD3100, que restauraba la integridad de los vasos sanguíneos.
Las nanopartículas podrían entonces alcanzar su objetivo, donde liberarían el fármaco, bloqueando así la entrada de las células mieloides inmunosupresoras en la masa tumoral.
Esto permitió que las células inmunitarias mataran el tumor y retrasaran su progresión.
“Si no tienes flujo de sangre, nada llegará a tu objetivo.
Por eso los tumores son tan inteligentes. Pero AMD3100 restaura los conductos, que es lo que permite que las nanopartículas lleguen al tumor”, dijo Castro.
Otros estudios en ratones y líneas celulares de pacientes demostraron que el acoplamiento de la nanopartícula AMD3100 con radioterapia mejoró el efecto más allá de la nanopartícula o la radiación sola.
Entre los ratones cuyos tumores fueron eliminados, los investigadores luego reintrodujeron el tumor, simulando una recurrencia.
Sin ninguna terapia adicional, el 60 % de los ratones permanecieron libres de cáncer.
Esto sugiere que, como una vacuna, AMD3100 creó memoria inmunológica, lo que permitió que el sistema inmunológico reconociera y destruyera las células reintroducidas.
Si bien evitó una recurrencia en ratones, Castro dice que es un buen augurio para al menos retrasar la recurrencia en las personas.
“Cada glioma recurre. Es muy importante para la terapia del glioma tener esta memoria inmunológica”, dijo Castro.
Las pruebas iniciales mostraron poco o ningún impacto en la función hepática, renal o cardíaca y en los recuentos sanguíneos normales en los ratones después del tratamiento.
La nanopartícula tiene una base similar a las que se han probado previamente en humanos y han demostrado ser seguras.
Se necesitan pruebas de seguridad adicionales antes de pasar a un ensayo clínico.
Fuente: ACS